Antibiotika: Siegen die Keime?
Inhalt
- Antibiotika-Resistenz: Abesehbares Ende eines Krieges
- Antibiotikamißbrauch bei Neugeborenen
- Arzneimittel-Fälschungen als Motor der Resitenz
Absehbares Ende eines Krieges
Der Siegeszug der modernen Medizin „gegen Keime“ wird enden: Antibiotika-resistente Bakterien verbreiten sich weltweit mit rasanter Geschwindigkeit.
Die Krankenkassen mobilisierten am 20.01.2022 „letzte Waffen“ im Kampf „gegen“ resistente Bakterien. Sie zeigten damit vor allem:
Hilflosigkeit.
Nirgends ein Hinweis, dass man etwas Grundsätzliches aus den Fehlern der Vergangenheit gelernt habe. Die Pharma-Industrie hat das Dilemma seit langem erkannt, und die Neuentwicklung von Antibiotika aufgeben. Sie stieg (einer Dakota-Weisheit folgend) „von einem toten Pferd ab“. Denn es fehlt hinsichtlich der Vermarktung innovativer Substanzen „gegen Keime“ die Profit-Perspektive.
Die Produktion der zurzeit noch verfügbaren Substanzen wurde weitgehend nach Südostasien ausgelagert. Käme es dort zu Lieferengpässen, wäre Europa schlagartig betroffen, ohne über genügend alternative Produktionstätten zu verfügen.
Täglich sollen etwa 3.500 Menschen an Infektionen mit antibiotika-resistenten Bakterien versterben. Eine in Lancet publizierte Studie kommt zu dem Schluss, dass im Jahr 2019 etwa 1,2 Millionen Menschen an antibiotikaresistenten, bakteriellen Infektionen gestorben sind. Davon 20% unter dem Alter von fünf Jahren.
Das sind mehr als an AIDS oder an Malaria (beide je 700.000 Verstorbene). Viele dieser bakteriellen Infektionen, wären ohne die Resistenz im Prinzip behandelbar gewesen. (Laxminarayan 2022, ARC 2022)
Antibiotika-Resistenz beruht auf Missverständnissen, u.a. dass:
- lebende Organismen von immer neuen (durch Mutation entstandenen) Feinden umgeben seien, die es zu bekämpfen und auszurotten gelte, und
- man folglich immer neuere, durchschlagendere, effektivere Waffensysteme benötige.
Stattdessen wählen Antibiotika aus unendlich großen Ökosystemen die Mikroorganismen aus, die gegen sie unempfindlich sind. Resistente Bakterien sind also (selten) neu: Es vermehren sich meist Varianten, die es vorher auch schon gab, denen sich aber nun eine evolutionäre Lücke eröffnet. Ohne Antibiotika-Anwendungen hätten sie wenig Chancen, sich exponentiell zu verbreiten.
Die Widerstandsfähigkeit gegen ein Antibiotikum entsteht also nicht durch eine neue Mutation in einem Bakterium. Sie war vielmehr als genetische Variante schon vorher in vereinzelten Bakterien vorhanden, hatte sich dort aber bisher noch nicht als ein Überlebensvorteil erwiesen.
Resistente Bakterien sind nicht aggressiver als andere. Aber sie können möglichen chemischen Angriffen besser widerstehen. Und sie können ihr genetisch gespeichertes Wissen zur Herstellung resistenz-vermittelnder Eiweiße auch an artfremde Bakterien weitergeben.
Die Gelegenheit dazu ist besonders groß in medizinischen Einrichtungen von Schwellenländern, in Laboren oder im Abwasser von Großstädten (RKI 2018), aber natürlich auch auf Intensivstationen in Deutschland (Schneider 2017, Atlas Resitenzentwicklung)
Von bakteriellen Infektionen, wie Gonorrhoe, Tuberkulose oder Haut- und Darmbakterien, die nicht mehr behandelt werden können, wird vorwiegend aus Armutsregionen berichtet. (Johnson 2017, Bantubani 2014, Sharma 2017, Shah 2017, WHO 2017)
Weil Antibiotika weitgehend frei von staatlichen Kontrollen vermarktet werden, sind dort auch die Antibiotika-Konzentrationen in den Böden und im Abwasser hoch. Für Bakterien besteht in solchen belasteten Ökosystemen ein hoher Selektionsdruck, der zur Anzüchtung von „Superkeimen“ führt. (Jasovský 2016, STAT 2017, Changingmarkets 2017)
Bakterien-Kolonien als Ganzes sind „lernfähig“: Sie passen sich flexibel an ihre Umwelt an.
Aber manche Baktereingemeinschaften verfügen über Möglichkeiten sich als ganze Gruppe an wechselnde Umweltbedingungen anzupassen. In Sporenstadium können sie (unter Einwirkung von Antibiotika) ihren Stoffwechsel einstellen, und so extrem lange erhalten bleiben – während sie bei Nahrungszufuhr (ohne gefährliche Antibiotika) wachsen. Erstaunlicherwesie tun sie das in manchen Populationen nicht alle gleichzeitig. Sie zeigen vielmehr kollektive Gruppen-Verhaltensweisen, die an die „Schwarmintelligenz“ von Vogelscharen erinnert. Manche Bakterien wachsen bei ausreichendem Nahrungsangebot sehr rasch, und vermehren sich dann extrem schnell, andere verhalten sich aber auch bei besten Bedingungen eher „zögerlich“. Diese wachstums-gebremsten Bakterien hatten dann einen Vorteil, wenn die Umweltbedingungen (unter Laborbedingungen, z.B. bei Antibiotika-Zufuhr) plötzlich wieder ins Negative kippten. In experimentell instabilen gehaltenen Stress-Situationen überlebten am besten gemischte Population, die das Nahrungsangebot unterschiedlich rasch verzehrten. Die Bakterien schienen sich also strategisch zu verhalten. (Moreno-Gámez 2022)
In der Evolution setzen langfristig immer die Varianten durch, die sich in ein ökologisches Gefüge integrieren können. Bei jeder Infektion werden unendlich viel Varianten übertragen.
Genetische Typen, die – hoch-aggressiv – den Tod ihres Wirtes verursachen, werden weniger effektiv weitergetragen, als Erreger-Varianten, die es schaffen, ein Teil der normalen Flora zu werden. Angepasste keime sind nicht unbedingt nützlich für ihren Trägerorganismus, aber sie haben aufgehört zu schaden. Und so können sie von ihren Wirten leichter weitergeben werden.
Der Nutzen von Antibiotika, kann daher aus prinzipiellen Gründen immer nur zeitlich begrenzt sein. Ständig neue antibiotische „Kriegswaffen“ werden in absehbarer Zeit in vielen Bereichen nichts mehr taugen.
Der pharmazeutischen Industrie sind diese Zusammenhänge bekannt. Sie verliert zunehmend das Interesse an der aufwendigen Entwicklung neuer Antibiotika. Die Antibiotikaproduktion, die ohnehin überwiegend nach Asien verlagert wurde, erscheint vielen Konzernen als ein krankes Pferd, von dem man irgendwann absteigen werde.
Denn auch bei neuen Substanzen werden nach nur wenigen Jahren Resistenzen auftreten, so dass der Verkauf dieser Produkte wenig lukrativ sein wird. Der Mikrobiologe und Nobelpreisträger Joshua Lederberg (s. Lit.) forderte deshalb schon vor zwanzig Jahren einen Paradigmenwechsel in unserem Umgang mit den Mini-Lebewesen, da sie uns „im Guten wie im Bösen ausmachen“.
Die Verbreitung immer neuer resistenter Krankheits-Erreger beruht auf einer Verarmung ökologischer Systeme, die Lebewesen umgeben, und die sie ausmachen. Gründe für das Artensterben der nützlichen Mikroorganismen (in uns und um uns herum) liegen in der allgemeinen Verschlechterung ihrer vielfältigen Lebensbedingungen, u.v.a. durch industrielle Landwirtschaft, Vergiftung der Böden, der Meere und der Luft, und durch missbräuchliche Anwendung antimikrobieller Substanzen.
Beispiel: Der Phyrrus-Sieg über Heliobacter pylori.
Der Keims Heliobacter pylori, lebte mit der gattung Homo sapiens seit hundert-tausenden von Jahren zusammen. Er ist an der Entstehung von Magenkarzinom beteiligt. Deshalb wurde zunächst in den USA, dann weltweit versucht ihn auszurotten. Die Zahl der Neuerkrankungen an Magenkarziomfällen ging daraufhin zurück.
Allerdings nahmen dafür die Erkrankungszahlen von Speiseröhren-Verschluss-Störungen (Reflux-Ösophagitis) zu. Und in der Folge wurden deutlich steigenden Fallzahlen von Speiseröhrenkrebs beobachtet.
Der angerichtete Schaden der Helicobacter-Beseitigung war und ist möglicherweise größer als der Nutzen (Blaser 2017, Muñoz-Ramirez 2021. Es ist deshalb dringend nötig, intelligenter und strikter mit mikrobiellen Waffensystemen umzugehen (Jasovský 2016, OECD 2016, Blaser 2018)
Antibiotika-Resistenz lässt sich nicht aufhalten.
Das Auftreten resistenter Bakterien und immer neuer Viren müsste sie eigentlich zu einem Paradigmenwechsel im Umgang mit den Mini-Lebewesen führen, die uns umgeben und die uns ausmachen. Menschen sind Superorganismen, die u.a. aus intra- und extrazellulären Mikro-Organismen und Viren bestehen. Biologisch betrachtet, ist die „Kriegsmedizin“ des 19. Jahrhunderts („Identifizieren, Isolieren, Abwehren, Bekämpfen, Vernichten“) an ihrem Ende angelangt. (Hontschik 2022)
Je intensiver die Vielfalt der Lebewesen schrumpft (z.B. durch Antibiotika-Einsatz in der Landwirtschaft), desto weiter eröffneten sich gefährlichen Krankheitserregern evolutionäre Lücken (Wallace 2020, Laxminarayan 2022). Schon vor über 20 Jahren schrieb der Mikrobiologe Lederberg, dass „unser Leben (im Guten wie im Bösen) mit den Keimen verbunden sei„.
Kriege nutzen langfristig den Waffenproduzenten und Profiteuren. Sie verursachen gewaltige Schäden und führen zu nichts Gutem. Sie begünstigen keine friedlichen Entwicklungen.
Die Menschheit brauchte (statt immer neuer Kriege gegen irgendetwas) dringend ein Verständnis für System-Zusammenhänge, und für die komplexe Realität, in der wir leben: die uns umgibt, und die uns ausmacht. Reflexhaftes Handeln, das zu Gewalt und Gegengewalt führt, müsste dringend ersetzt werden: durch ein Verständnis für gewaltfreie Lösungsstrategien. Um endlich friedliche Wechselwirkungen in gesunden, resilienten Ökosystemen anzustreben, zu begünstigen und zu fördern.
Damit die Möglichkeit antibiotischer Therapie für wirklich lebensbedrohliche Ereignisse erhalten beleiben kann, müssen sinnlose und völlig unnötige Antibiotikaverschreibungen eingestellt werden.
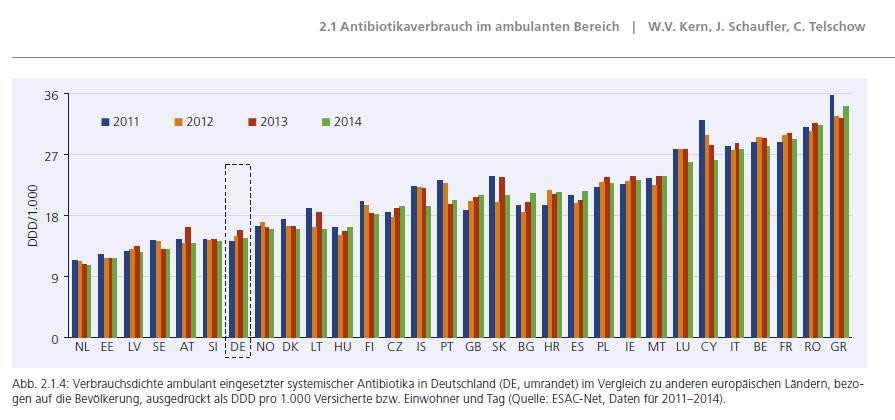
Germap 2015 (Version 02.06.2017): Warum verbrauchen Belgier dreimal soviel Antibiotika wie ihre niederländischen Nachbarn? Gibt es dafür rationale Gründe?
Hoffnungsvoller stimmt, dass es in den Niederlande gelungen ist, den Antibiotikaverbrauch von 2007-2015 um 60% zu senken.
Ein positives Beispiel dafür ist der niederländische „Antimicrobial resistance action“-Plan. Er konzentrierte sich vor allem auf eine Reduzierung des Antibiotikaeinsatzes in der Landwirtschaft. Dabei seien „klare ‚top-down‘ Entscheidungen“ von einer „starken ‚bottom-up‘ Bewegung der Umsetzung“ begleitet worden. Und zusätzlich habe die intensivere Aufklärung der Bevölkerung die Nachfrage nach Antibiotika-Therapien gesenkt. (Sheldon 2016).
Wir leben in der Nach-Antibiotikaphase. The post-antibiotic era is here.
Kwon JH et al: Science 30.07.2021, 373(6554)471
Zitat: „Eine globale Antwort auf diese komplexe Gesundheitsgefahr erfordert das Engagement einer breiten Palette von Akteuren, Regierungen, Behörden und der Öffentlichkeit bis hin zu Experten in den Bereichen Gesundheit, Ernährung, Umwelt, Wirtschaft, Handel und Industrie. …. Häufig wird von „Krieg gegen Superbugs“ oder „Kampf gegen Antibiotika-Resistenz“ gesprochen. Diese Schuldzuweisung ist irreführend. Der Einsatz von Antibiotika selektiert Bakterien, die gegen die Medikamente resistent sind. Ursächlich entsteht aber der Antibiotikaresistenz beim Menschen durch den starken Druck, infolge von Missbrauch und unnötiger Nutzung von Antibiotika.“ (Mendelson 2017, sinngemäß übersetzt)
Mehr
Ökosystem Mensch:
- Pädiatrische Praxis 2023 99(2)193-204 (pdf)
- Erst-Publikation: Gynäkologische Praxis 2020, 46(2)187-197
Ökosystem Zelle:
- Internistische Praxis 2021 63(3)373-380 (pdf)
- Aktualisierung im Druck: Pädiatrische Praxis Mai 2023
Ergänzend
Links
Mikrobiologie und Hygiene
- Blaser M: Microbiom (2017) ; Missing Microbes (2014)
- „Sei kein Brähmer! (Deut. Gesell Krankenhaushygiene)
Vorträge
- Chutkan R: Live Dirty, Eat Clean! Why The Microbiome Is The Future Of Medicine.
- Dinan T: Microbiome, Brain and Behavior.
- Hsiao E: How the microbiome affects brain and behavior.
Tiermedizin
- Arte 2017: Killerkeime aus dem Stall
- Forderungen der Ärztinitiative gegen Massentierhaltung 2021 –
- Buko-Pharma 2021 –
- Tierärzteverband 2021 –
- BfR 2021 –
- Bundes-Umweltamt 2021 –
Literatur
- Atlas der Antibiotika-Resistenz (Pfizer 2017)
- ARC: Antimicorbial Resistance Collaborators: Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis, Lancet 19.01.2022
- Bantubani N: High Rates of Potentially Infectious Tuberculosis and Multidrug-Resistant Tuberculosis (MDR-TB) among Hospital Inpatients in KwaZulu Natal, South Africa Indicate Risk of Nosocomial Transmission. PLOS 13.04.2014
- Blaser M: Antibiotika Overkill. Herder 2017. Originaltitel Missing Microbes: How the Overuse of Antibiotics Is Fueling Our Modern Plagues. Web: a) Med.Nyu.edu b) martinblaser.com
- Changing-Markets.org: Superbugs in the Supply chain, 2017 (35 MB!)
- Chin T: Antibiotic Resistance. Health Affairs, Mai 2015
- Dik V: Frequent Use of Antibiotics Is Associated with Colorectal Cancer Risk: Results of a Nested Case–Control Study. Dig Dis Sci. 2016; 61: 255–264.
- Gérard P: Gut Microbiota and Obesity. Cell Mol Life Sciences CMLS, 2016 Jan;73(1):147-62
- Germap 2015 (Version 02.06.2017)
- Hume D: Bechamp or Pasteur: A Lost Chapter in the History of Biology, 1942
- Jasovský Dušan: Antimicrobial resistance—a threat to the world’s sustainable development, Ups J Med Sci. 2016; 121(3): 159–164 – Development Dialog Paper 2016: Antimicrobial Resistance – A Threat to the World’s Sustainable Development
- Johnson EP et al: The prospect of untreatable gonorrhea. An international threat requires a coordinated international response. BMJ 2017; 358:j3973
- Lachenal G: The Lomidine Files. John Hopkins University Press. 2017
- Laxminarayan R: The overlooked pandemic of antimicrobial resistance, Lancet 19.01.2022:
- Lederberg: https://www.project-syndicate.org/commentary/microbiology-s-world-wide-web
- Mendelson M et al: Antibiotic resistance has a language problem, Nature 2017, 545, 23–25
- Moreno-Gámez: How bacteria navigate varying environments, Science 2022, 378(6622):845, pubmed.ncbi.nlm.nih.gov/36423298/
- Muñoz-Ramirez Z et al: A 500-year tale of co-evolution, adaptation, and virulence: Helicobacter pylori in the Americas, The ISME Journal, 2021, 15(5),78–92
- OECD: Antimicrobial Resistancce, 2016
- Okada H The ‘hygiene hypothesis’ for autoimmune and allergic diseases: an update. Clin Exp Immunol. 2010; 160(1):1–9
- Packard R: A History of Global Health. John Hopkins University Press. 2016
- RKI: Antibiotika Resitenz
- Rogawski E et al.: Use of antibiotics in children younger than two years in eight countries: a prospective cohort study, Bull of the World Health Organization, 2017, 95(1)16-17
- Saam M et a: Evaluation of antibiotic awareness campaigns, World Health Organization, Expert Committee on the Selection and Use of Essential Medicines, 2017
- Schneider S et al. : Surveillance der Antibiotika-Anwendung und Reisitenzentwicklung auf Intensivstationen. DÄB 15.12.2017; 1114(50)858-59.
- Shah NS et al: Transmission of extensively drug-reistant tuberculosis in South Africa, NEJM 2017, 376(3)-243-53
- Sharma A et al: Estimating the future burden of multidrug-resistant and extensively drug-resistant tuberculosis in India, the Philippines, Russia, and South Africa: a mathematical modelling study. The Lancet Infect Diseases 2017, 17(7):707–715.
- Sheldon T: Saving antibiotics for when they are needed: the Durch exemple. BMJ Okt 2016, 2:130
- Wallace R 2020: Dead epidemiologists: https://monthlyreview.org/product/dead-epidemiologists-on-the-origins-of-covid-19/
- WHO 2007. Weyer: Case Study South Afrika
- WHO 2017: Antimicrobal Resistance
- WHO: Multidrug resistant tuberculosis
- WHO 27.02.2017: The dirty dozen: New antibiotics are urgently needed
- Yin Cao et al: Long-term use of antibiotics and risk of colorectal adenoma Gut Mar 2017, gutjnl-2016-313413
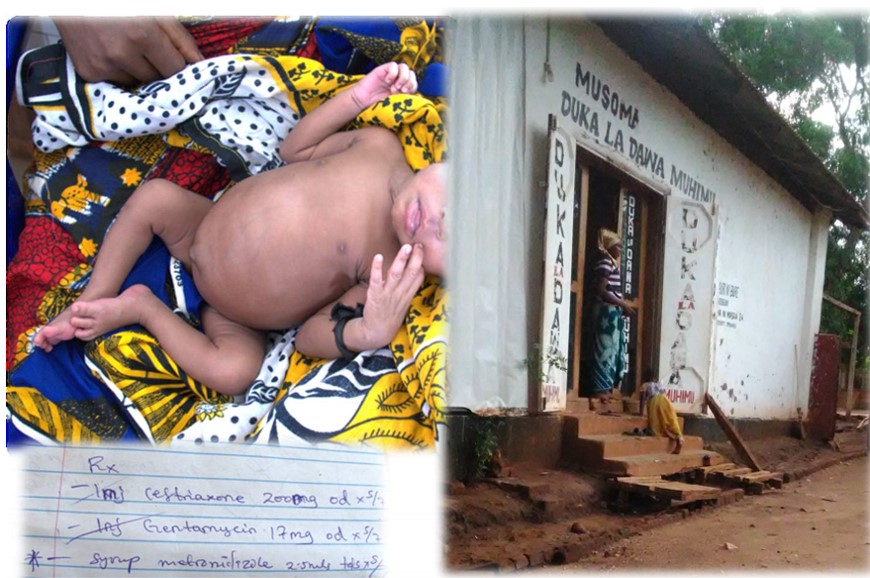
Antibiotika und Neugeborenensepsis
Zitat „Der weit verbreitete Einsatz von Antibiotika bei Säuglingen und offenbart besorgniserregende Zusammenhänge zwischen der Exposition gegenüber Antibiotika und verschiedenen immunologischen, metabolischen und neurologischen Gesundheitszuständen sowie dem Auftreten von Kombinationen dieser Zustände in der Kindheit. Die mit der Antibiotikaexposition in den ersten zwei Lebensjahren verbundenen Gesundheitsrisiken hängen mit der Anzahl, der Art und dem Zeitpunkt der Verschreibung zusammen. Bemerkenswert ist, dass der Zusammenhang zwischen Antibiotikaexposition und nachteiligen gesundheitlichen Folgen, einschließlich Asthma, allergischer Rhinitis, atopischer Dermatitis, Zöliakie, Übergewicht, Adipositas, ADHS und Lernschwäche, auch nach Bereinigung um anerkannte und wichtige Störfaktoren bei Säuglingen und Müttern bestehen blieb.“ Aversa Z, Mayo Clinic 2021
Neugeborenen Sepsis
Neugeborene sind besonders infektions-gefährdet. Ihr Immunsystem ist unreif und reagiert überschießend und wenig effektiv. Gefährliche Infektionen u.a. mit Streptokokken der Gruppe B (GBS) und E. coli können sehr plötzlich einsetzen (Early Onset Neonatal Sepsis – EONS).
Krankheitssymptome zeigen sich bei über 90 Prozent der Kinder, die eine Sepsis entwickeln, innerhalb von 24 bis 48 Stunden. Deshalb ist es (unabhängig von Voruntersuchungen und Screening-Ergebnissen) wichtig, in den ersten Stunden und Tagen nach der Geburt besonders genau auf das Neugeborene zu achten (Polin 2012, Berger 2013). Bei Sepsis handelt es sich um ein multifaktorielles Geschehen mit einer Überreaktionen des Immunsystems auf die Vermehrung eines auslösenden Erreger (Halis 2016, Shubin 2011, Shah 2014, Vincent 2013) oder auf das Fehlen einer schützenden normalen Flora (Pamer 2016).
Wenn es gelingt, das Immunsystem soweit zu beruhigen, dass es die körpereigenen Zellen nicht schädigt, steigen die Überlebensraten (Castellheim 2009; Crea 2012). Die Dämpfung über-erregter Darm- und Immunfunktionen eines Neugeborenen erfolgt im Wesentlichen, neben der antibiotischen Therapie, durch die Übertragung des mütterlichen Mikrobioms durch die Vagina und das Stillen (Trend 2016, Mueller 2015) und die Vagus-Stimmulation im Rahmen Mutter-Kind-Bindung (Bonding) (Matteloni 2012).
Die Gesellschaft für Neonatologie und pädiatrische Intensivmedizin e.V. (GNPI) empfiehlt in der Schwangerschaft einen Scheidenabstrich, und bei positivem Nachweis von GBS vor der Geburt prophylaktisch ein Antibiotikum zu verabreichen (AWMF Leitlinie, 09.03.2016). Diese Leitlinie soll bis 2021 gültig sein, die Publikationen, auf die sich die Leitlinie bezieht, umfassen den Zeitraum der Jahre 2000 bis 2014. Die Inzidenz der GBS Infektionen bei Neugeborenen wird in Deutschland auf 0,4 pro 1.000 Lebendgeburten geschätzt, 60% von ihnen erlitten einen EONS, die Sterblichkeitsrate betrug 4.3%. (Flügge 2006). Bei der großen Vielfalt der GBS-Stämme kommen die invasiven Stämme, die eher mit EONS assoziiert sind, deutlich seltener vor als die nicht-invasiven. Zwischen 2008 und 2010 wurde von der gleichen Arbeitsgruppe „erneut eine nationale Studie durchgeführt. Die Inzidenz der neonatalen GBS-Sepsis lag dort etwa 30% unter der von 2001 bis 2003 (0,47/1000). Die Daten sind zur Publikation eingereicht. Die Inzidenz der neonatalen E. coli-Sepsis machte knapp die Hälfte der GBS-Fälle aus.“ (Zitat: Berner 2016)
Das Risiko der durch GBS verursachten EONS kann durch Antibiotika-Gaben offenbar um etwa 80 Prozent gesenkt werden (Ohlsson 2013). Allerdings sind aber manche Frauen, bei denen eine GBS-Besiedlung in der Schwangerschaft nachgewiesen wurde, bei erneuten Tests vor der Geburt wieder negativ, so dass sie die empfohlenen Antibiotika unnötig erhalten. (Young 2011). In den USA führte die Einführung einer Antibiotikaprophylaxe zu einem Rückgang GBS-assoziierter Neugeborenensepsis. Zeitgleich stiegen in den USA zeitgleich Fällen mit EONS an, die unter anderem durch E. coli ausgelöst wurden (Shah 2014).
Die genannte AWMF-Leitlinie wurde nach Transparenz-Kriterien überprüft und erhielt bei Leitlinien-Watch durch das Erreichen von nur 5 von 18 Punkten die Bewertung „Reformbedarf“. Sie unterscheidet sich zudem von der des Royal College of Ostetricians and Gynaecologists (RCOG 2014). Dort werden die Indikation für Screening und prophylaktische Antibiotikagaben deutlich restriktiver gesehen. Eine Überarbeitung dieser Leitlinien auf der Basis exakter „Evidenz Level“ ist noch für 2016 angekündigt worden. (RCOG 2016)
Beispiel: Antibiotika und Adipositas
„Es gibt ein kritisches Fenster der Entwicklung der Kommunikation zwischen Zellen und Bakterien“ (AG Martin Blaser, NYU School of Med., Cox 2014). Werde diese Periode gestört, z.B. durch lang-dauernde Antibiotikadosen, entstünden bleibende Schäden des Stoffwechsels und der mikrobiellen Besiedlung des Darmes. Diese Beobachtung könne u.a. zur Erklärung der weltweiten Epidemie von Adipositas beitragen.
Zitat: „Die Darmflora wird mit der Geburt erworben. An einer stabilen mikrobiellen Gemeinschaft sind sehr genau bestimmbare Schlüsselorganismen beteiligt. Ein Zerstörung der natürlichen Bakterien während ihrer Reifungsphase durch niedrig dosierte Antibiotikadosen kann Veränderung des (Fett- und Kohlehydrat)-Stoffwechsels bewirken. Wir zeigen hier, das niedrig dosiertes Penicillin, wenn es nach der Geburt gegeben wird, im Ileum Veränderungen der Gen-Expression auslöst, die bei der Immunfunktion beteiligt ist. Auch wenn niedrig dosiertes Penicillin auf die frühe Phase des Lebens beschränkt wird, stört es den Stoffwechsel so sehr, dass bleibende körperliche Veränderungen ausgelöst werden. Dies verweist darauf, dass die Interaktionen mit den Bakterien der frühen Lebensperiode kritisch sind für die spätere Stoffwechsellage. Niedrig dosiertes Penicillin in der frühen Lebensphase begünstigt den Effekt, dass fettreiche Nahrung zu Adipositas führt.“ Freie Übersetzung aus Cox 2014
Sachgerechte Aufklärung
„Antibiotika sind lebenswichtig für die Gesundheitsversorgung … aber die Kosten für die Gemeinschaft und die zukünftige Gesundheit eines Menschen werden durch den übermäßigen Einsatz von Antibiotika verursacht. Zuerst müssen wir diese Exzesse kontrollieren … und die biologische Vielfalt wiederherstellen“ (Blaser 2016)
Für die Beratung schwangerer Frauen und junger Mütter, sind vor Screening-Maßnahmen und therapeutischen Eingriffen, die eine gesunde Entwicklung des Mikrobioms beeinträchtigen könnten, dokumentierte Aufklärungsgespräche erforderlich. Dazu gehört:
Verweis auf die geltende AWMF-Leitlinie in Deutschland (und Hinweis, dass sich Leitlinien in anderen Ländern davon unterscheiden (RCOG 2016). Durch Antibiotikagaben GBS-positiver Schwangerer vor Geburt kann das Risiko für GBS-assoziierte EONS gesenkt werden, für E. coli ausgelöste EONS eher nicht.
Bei Antibiotikagaben unter der Geburt kann das Risiko für Darmfunktionsstörungen (u.a. auch Necrotisierende Entero-Colitis) zunehmen. (Morrow 2013) Möglich sind auch langfristige Auswirkungen für die Entwicklung des Immunsystems ergeben, durch Störung des „window of opportunity) für die das Zusammenspiel von Mikrobiellen, immunologischen und neuronalen Funktionen. (Gensollen 2016, Neu 2016, Rautava 2016, Mueller 2015)
Die Übertragung des Mikrobioms in den ersten Lebenstagen ist von einer entscheidenden Bedeutung für die weitere gesunde Entwicklung des Kindes (Pennisi 2016), und Störungen in dieser Lebensphase gehen einher mit einem höheren Risiko sowohl für akute wie auch chronische Erkrankungen (Tamburini 2016, Vatanen 2016)
“The early life education of the immune system during the „window of opportunity: when microbial colonization has a potentially critical impact on human health and disease.” Gensollen 2016
Literatur
- Aagaard K et al. (2012): A Metagenomic Approach to Characterization of the Vaginal Microbiome Signature in Pregnancy, PLOS One 2012, PLoS ONE 7(6): e36466.
- Aagaard K et al. (2014): The Placenta Harbors a Unique Microbiome SciTransl Med, 2014; 6: 237ra65
- Abrahamson TR et al (2014): Low gut microbiota diversity in early infancy precedes asthma in school age, Clin Exp Allergy 2014, 44:842-850
- Arrieta MC et al.: Early infancy microbial and metabolic alterations affect risk of childhood asthma Science Translational Medicine 30 Sep 2015: Vol. 7, Issue 307, pp. 307ra152
- Ash C et al: Manipulating the microbiota. Science 26.04.2016, 352(6285):531
- ASM 2014: American Society of Microbiology – FAQ Microbiome 2014
- AWMF: Sepsis bei Neugeborenen – frühe Form – durch Streptokokken der Gruppe B, Prophylaxe, Registernummer 024-020, Stand: 09.03.2016 , gültig bis 08.03.2021: http://www.awmf.org/leitlinien/detail/ll/024-020.html
- Aversa Z et al: Association of Infant Antibiotic Exposure With Childhood Health Outcomes. Mayo Clinic Proceedings 2021, 96(1):66-77
- Azad MB et al: Infant antibiotic exposure and the development of childhood overweight and central adiposity. Int J Obes (Lond). 2014 Oct;38(10):1290-8. www.ncbi.nlm.nih.gov/pubmed/25012772
- Bearfield, C. et al.: Possible association between amniotic fluid micro-organism infection and microflora in the mouth. BJOG. 109(5):527–533 (2002)
- Belkaid Y et al: Role of the Microbiota in Immunity and Inflammation, Cell 2014, 157:121-141.
- Belzer C et al (2014). Dynamics of the Microbiota in Response to Host Infection. PLoS One. 2014 Jul 11;9(7):e95534. eCollection 2014.
- Berger et al.: Empfehlungen zur Prävention und Therapie von Termin- und knapp frühgeborenen Kindern (> 34 SSW) mit erhöhtem Risiko einer perinatalen bakteriellen, Revidierte Empfehlungen der Schweizerischen Gesellschaft für Neonatologie in Zusammenarbeit mit der Pädiatrischen Infektiologiegruppe Schweiz (PIGS). 2013: 24(1): 11–13. (2013)
- Blaser M: Antibiotic use and its consequences for the normal microbiome, Science 26.04.2016, 352(6285):344-355
- Carabotti M The gut-brain axis: interactions between enteric microbiota, central and enteric nervous systems Annals of Gastroenterology (2015) 28, 203-209
- Castellheim, A. et al.: Innate Immune Responses to Danger Signals in Systemic Inflammatory Response Syndrome and Sepsis, Scandinavian Journal of Immunology 69, 479–491 (2009)
- Cho I et al: Antibiotics in early life alter the murine colonic microbiome and adiposity Nature 2012, 488, 621–626
- Chu D & Aagaard KM: Microbiome: Eating for trillions. Nature 532, 316–317
- Coyte KZ: The ecology of the microbiome: Networks, competition, and stability. Science, 06.11.2015, 350(6261):663-66
- Cox L et al.: Altering the Intestinal Microbiota during a Critical Developmental Window Has Lasting Metabolic Consequences, Cell 2014, 158(4):705–721,
- Crea, P. et al.: Innate immune inflammatory response to danger: when, how, and why does a friend become a foe? Eur Heart J. (2012)
- Daley D (2014): The evolution of the hygiene hypothesis: the role of early-life exposures to viruses and microbes and their relationship to asthma and allergic diseases. Curr Opin Allergy Clin Immunol. 2014 Oct;14(5):390-6.
- De Palma G et al (2014): The microbiota-gut-brain axis in gastrointestinal disorders: stressed bugs, stressed brain or both? J Physiol. 2014 Jul 15;592(Pt 14):2989-97
- Dinan TG et.al: The impact of gut microbiota on brain and behaviour: implications for psychiatry. Curr Opin Clin Nutr Metab Care. 2015, 18(6):552-8
- Dinsmoor, M.J. et al.: Use of intrapartum antibiotics and the incidence of postnatal maternal and neonatal yeast infections. Obstetrics and gynecology. 106 (1): 19–22 (2005)
- Douvier, S. et al.: Chorioamnionitis with intakt membranes caused by Capnoytophaga sputigena. Eur J Obst Gyn Reprod Biol. 83(1):109–112) (1999)
- Eisenstein M: Bacterial Broadband, Nature 19. Mai 2016, 533:S104-S105
- Faa G et al: Fetal programming of the human brain: is there a link with insurgence of neurodegenerative disorders in adulthood? Curr Med Chem. 2014;21(33):3854-76,
- Fernández, l. et al.: The human milk microbiota: origin and potential role in health and disease. Pharmacological Research. 69: 1–10 (2013)
- Flügge K. et al.: Incidence and Clinical Presentation of Invasive Neonatal Group B Streptococcal Infections in Germany. Pediatrics 2006, 117(6) :e1139-45
- Flügge K. et al: Genetic Differences Between Invasive and Noninvasive Neonatal Group B Streptococcal Isolates. The Pediatric Infectious Disease Journal 2011. 30(12):1027-31 ·
- Foster JA et al: Gut microbiota and brain function: An evolving field in neuroscience. Int J Neuropsychopharmacol. 2015 Oct 4.
- Gensollen et al: How the colonization by microbiota in early life shapes the immune system, Science 352(6285): 539-543,
- Gustavson M et al (2014): Modules, networks and systems medicine for understanding disease and aiding diagnosis, Genome medicine 2014, 6:82, http:genomemedicine.com/content/6/10/82
- Haghikia A et al: Dietary Fatty Acids Directly Impact Central Nervous System Autoimmunity via the Small Intestine. 2015 Oct 20;43(4):817-29.
- Halis H: In the diagnosis of neonatal sepsis importance of gelsolin and relationship with mortality and morbidity. Medical Hypothesis 14.06.2016. www.sciencedirect.com/science/article/pii/S030698771630250X
- Jäger H: Das Mikrobiom und die Immunentwicklung des Neugeborenen, DZKF 2016; 4:45-49 & Gyne 2016, 6:30-34
- Jäger H: Fetale Herzsteuerung: Reflexhaft und chaotisch, DHZ, 2014, 11:38-43, Mütterliche Mikroflora, DHZ 2014, 2: 67-71,: Das Mikrobiom des Menschen. DHZ 2016, 68(2):79
- Jeurink P.V. et al. (2013): Human milk: a source of more life than we imagine. Beneficial Microbes. 4(1): 17–30 Wageningen Academic. (2013)
- Jones ML et al (2014): Emerging science of the human microbiome. Gut Microbes. 2014 Jul 11;5(4).
- Kaiser J (2014): Gearing up for a closer look at the human placenta, Science 2014, 344(6188) 1073
- Kernbauer E et a.:An enteric virus can replace the beneficial function of commensal bacteria. 2014 Dec 4;516(7529):94-8.
- LaTunga, M. S. et al.: A Review of the Source and Function of Microbiota in Breast Milk. Semin Reprod Med. 32: 68–78 (2014)
- Matteloni, G. et al. (2012): The vagal innervation of the gut and the immune homeostasis. 0: 1–9 (2012)
- Maynard C et al. (2012): Reciprocal interactions of the intestinal microbiota and the immune System, Nature Review. 489:231-241 (2012)
- Meadow J et al: Humans differ in their personal microbial cloud, Peer J, 23.09.2015, pdf
- Morrow, A.: Earlymicrobial and metabolic signatures predict later onset of necrotising enterocolitis in preterms infants, 20131:13
- Mueller et al: The infant microbiome development: mom matters, Trends in Molecular Med. 2015, 21(2):109-117
- Neu J: Themicrobiome during pregnancy and early postnatal life. J1Semin Fetal Neonatal Med. 2016 Jun 7. pii: S1744-165X(16)30015-4
- O’Mahony SM et al: Early-life adversity and brain development: Is the microbiome a missing piece of the puzzle? 2015, pii: S0306-4522(15)00895-7.
- Ogilvie L: The human gut virome: a multifaceted majority. Front Microbiol 2015, 6:918. Volltext
- Ohlsson, A. et al.: Intrapartum antibiotics for known maternal Group B streptococcal colonization. Cochrane Database Syst Rev. Jul 8;(3):CD007467. (2009)
- Pamer E: Resurrecting the intestinal microbiota to combat antibiotic-resistant pathogens, Science 352(6285):535-538,
- Pennisi E: The right gut microbes help infants grow. Science 19.02.2016, 351(6275):802
- Pittis A: Late acquisition of mitochondria by a host with chimaeric prokaryotic ancestry. Nature 03.03.2016, 531:101-4
- Polin, R. et al.: Management of Neonates with Suspected or Proven Early-Onset Bacterial. 129; 1006 (2012)
- Praveen P et al: The role of breast-feeding in infant immune system: a systems perspective on the intestinal microbiome. Microbiome 2015, 3(1):41.
- Prince, A. L. et al.: The Microbiome and Development: a mothers perspective. Semin Reprod Med. 32: 14–22 (2014)
- Rajjilić-Stojanović M et al (2013): Long-term monitoring of the intestinal microbiota composition Environ Microbiol 2013, 15:1146-1159
- Rautava S: Early microbial contact, the breast milk microbiome and child health Health and Disease Journal of Developmental Origins of Health and Disease/ Volume 7 / Issue 01 / February 2016, pp 5-14
- RCOG (Royal College of Ostetricians and Gynaecologists) Green–top Guideline No. 36 Stand 18.07.2012 (aktualisiert im Dezember 2014) – Audit 29.01.2016:
- Relman DA: The Human Microbiome and the Future Practice of Medicine. JAMA 2015, 314(11):1127-28
- Rialdi A: Topoisomerase 1 inhibition suppresses inflammatory genes and protects from death by inflammation. Science 27 May 2016, 352(6289):1074
- Rogers G: Germs and joints: the contribution of the human microbiome to rheumatoid arthritis, Nature Medicine 2015, 21(8):839-841
- Saint-Georges-Chaumet Y et al: Microbiota-mitochondria inter-talk: consequence for microbiota-host interaction. Pathog Dis. 2015 Oct 23. pii: ftv096. [Epub ahead of print]
- Scarpellini E: The human gut microbiota and virome: Potential therapeutic implications Dig Liver Dis. 2015, pii: S1590-8658(15)00414-4. Volltext
- Shah, B. et al.: Neonatal sepsis. An old problem with new insights. Virulence. 5(1): 170–78 (2014)
- Sherman MP et a (2015)l: Gut microbiota, the immune system, and diet influence the neonatal gut-brain axis. Pediatr Res. 2015 Jan;77(1-2):127-135. . Epub 2014 Oct 10.
- Shubin, N. J.: Anti-Inflammatory Mechanisms of Sepsis. In: Herwald, H. (Hrsg.): Sepsis – Pro- Inflammatory and Anti- Inflammatory Responses. Contrib Microbiol. Basel. Karger. vol 17, pp 108–124 (2011)
- Stokholm, J. et al.: Antibiotic use during pregnancy alters commensal vaginal microbiota, Clin Microbiol Infect. Oct 1. . PDF: (2013)
- Tamburini S et al.: The microbiome in early life: implications for health outcomes. Nature Medicine July 2016, 22(7): 713-21
- Strachan DP (1989): Hay fever, hygiene and household size, DMJ 1989, 299:1259-1260
- Trend St et al: Levels of innate immune factors in preterm and term mothers’ breast milk during the 1st month postpartum, British Journal of Nutrition (2016), 115, 1178–1193
- Turfkruyer M et al: Breast milk and its impact on maturation of the neonatal immune system. Curr Opin Infect Dis. 2015 Jun;28(3):199-206.
- van der Burgh R et al.: Mitochondria in autoinflammation: cause, mediator or bystander? Trends Endocrinol Metab. 2015 Apr 4. pii: S1043-2760(15)00048-X.
- Vieira SM: Diet, Microbiota and Autoimmune Diseases, Lupus. 2014 May; 23(6): 518–526. Volltext
- Vincent, J. L. et al.: (2013): Sepsis definitions: time for change. Lancet. 381: 774–75 (2013)
- Wang CH et al.: Oxidative stress response elicited by mitochondrial dysfunction: implication in the pathophysiology of aging Exp Biol Med (Maywood). 2013 May;238(5):450-60.
- Wekerle 2015: Vortrag auf dem 88. Kongress der Deutschen Gesellschaft für Neurologie in Klammern DGM in Düsseldorf, GGN Pressemitteilung . Vorliegende Publikation: HohlfeldR, Wekerle H: Multiple Sklerose und Mikrobiota Vom Genom zum Metagenom? Der Nervenarzt August 2015, Volume 86, Issue 8, pp 925-933 First online: 24.06.2015
- Witkin SS (2015): The vaginal microbiome, vaginal anti-microbial defence mechanisms and the clinical challenge of reducing infection-related preterm birth BJOG 2015;122:213–219.
- Young, B. C. et al.: Evaluation of a rapid, real-time intrapartum group B streptococcus assay. Am J Obstet Gynecol. 205(4): 372 e371–376 (2011)
Arzneimittel-Fälschungen
Fake Drugs fördern Antibiotikaresistenz
In unkontrollierten, mit Medizinprodukten überschwemmten Märkten suchen KonsumentInnen desorientiert nach schnellen Lösungen. Die Qualität der angepriesenen Produkte können sie meist nicht einschätzen. Vieles kann, insbesondere in Afrika oder Asien, minderwertig oder gefälscht sein, und oft werden auch qualitativ hochwertige Medikamente völlig unnötig geschluckt oder gespritzt.
Gefälschte Antibiotika sind oft über- oder unterdosiert, und erleicherten damit die Selektion resitenter Keime.
Schwemme gefährlicher Medizinprodukte
Die Gesamtmenge gehandelter Müll-Präparate kennt niemand. 2014 wurden in Afrika 113 Millionen gefälschte Antibiotika und Anti-Malaria-Medikamente beschlagnahmt (AFP 2014). Die Verpackungen dieser „Fake drugs“ unterschieden sich kaum von den Originalen. Sie stammen meist aus Süd-Ost-Asien stammen. So sollen 97% der gefälschten Pharmaprodukte in Nigeria u.a. in Indien, China (und Taiwan) hergestellt worden sein. Dort die Produktion der Fake drugs von den Behörden offenbar toleriert, weil Abgaben gezahlt werden. (Euroaktiv 24.01.2017) Von 2012 bis 2016 seien in afrikanischen Häfen (laut Welthandelsorganisation) mehr als 750 Millionen Fake Drugs sichergestellt worden. Und eine Studienanalyse deutet in siebzehn Ländern auf einen deutlichen Anstieg des Verkaufs gefälschter Medikamente hin. (Nayyar 2015
Qualitativ minderwertige Arzneimittel enthalten andere Inhaltsstoffe, als auf der Packung angegeben. Oder richtige Inhaltsstoffe zu hoch, oder zu niedrig dosiert. Oder Wirksubstanzen, die durch unsachgemäße Lagerung bereits zerfallen sind. Oder sie bestehen aus giftigen Abfallprodukten.
Beispiel: Fake-Drug-Epidemie im Kongo
Im Dezember 2014 wurde im Nordosten der Demokratischen Republik Kongo, im Distrikt Ituri, ein Ausbruch von Meningitis gemeldet. Über eintausend Patienten waren erkrankt, ein Drittel von ihnen jünger als fünf Jahre. Als Ursache vermutete man zunächst Meningitis-Infektionen, weil die Betroffenen Nackensteifigkeit aufwiesen, und behandelte die ersten Fälle mit Antibiotika. Genauere Untersuchungen deuteten dann aber auf eine Vergiftung hin: Nahezu alle Patienten waren (aus welchen Gründen auch immer) dem Beruhigungsmittel Diazepam® (ein Benzodiazepin) behandelt worden. Im Blut der Betroffenen fand man hohe Konzentrationen einer anderen Substanz: von Haloperidol. Die Tabletten, die Diazepam® enthalten sollten, waren offenbar gefälscht worden. Die Nachfrage nach Diazepam® war in der vom Bürgerkrieg betroffenen Region hoch, und die Tabletten waren frei in Kram-Läden verkauft worden.
Die Bevölkerung von der eigentlichen Gefahr gefälschter Arznei zu überzeugen, erwies sich als schwierig, denn Diagnosen „äußerer Angriffe“ durch Infektionserreger oder durch Hexerei erschienen den meisten Betroffenen als wesentlich nachvollziehbarer. (Peyraud 2017)
Gesundheitsrisiko: schlechte Medizin
Das Geschäft mit der Medizin gehört zu den stabil und krisenfest wuchernden Wirtschaftszweigen, und vieles was in diesem Markt angeboten wird ist unnötig, von schlechter Qualität oder gefährlich. Die Auswirkungen der Gesundheitswirtschaft auf die Gesundheit wurden noch nicht systematisch untersucht. Wirksamer und guter Hochleistungsmedizin steht in vielen Ländern ein gefährliches Geschäft mit Leidensdruck und Angst gegenüber. Die Suche nach Gesundheit führt dann zu Krankheit.
Heute is kein Land dieser Erde mehr in der Lage, den gesamten Umfang der umlaufenden Arzneimittel zu kontrollieren.
Schlechte Medizin bedroht besonders ärmere Länder: Denn dort verschimmeln in wackeligen Krämerläden am Ende der Welt Psychopharmaka und Antibiotika zwischen Coca-Cola-Flaschen, Zigarettenpackungen und Dosenfleisch. Die Pillen werden dort, je nach Kaufkraft der Kunden, stückweise abgegeben. Ob sie dann gefälscht sind oder nicht, verändert nur das Risiko des Schadens, den sie anrichten. Ein Nutzen geht von ihnen aber nur sehr selten aus.
Die Verbraucher, die wegen ihrer Lebens- oder Gesundheitsprobleme Pharmaprodukte und medizinische Dienstleistungen einkaufen, können die Qualität nicht beurteilen.
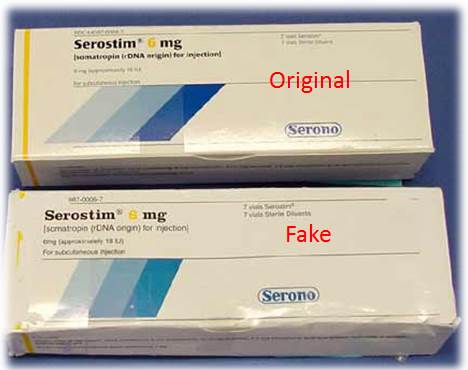
Die Herstellung von Fake Drugs ist nicht eindeutig illegal.
Arzneimittelfälschungen sind, im Gegensatz zur Herstellung gefälschter Banknoten, kein internationaler Straftatbestand (Newton 2014).
Eine Resolution des Europarates von 2010, die die Herstellung und den Verkauf von gefälschten Medikamenten untersagt, wurde bisher nur von wenigen Staaten unterzeichnet. Auch Deutschland die Resolution bis heute nicht ratifiziert.
Das liegt u.a. daran, dass ein Straftatbestand so schwierig zu definieren wäre: Denn als „counterfeit drug“ (gefälschtes Medikament) würde auch ein qualitativ hochwertiges Produkt gelten, das im Widerspruch zu einer registrierten Trademark verkauft wird, als ein Generikum, dessen Verkauf die Profite des Originalherstellers mindert. (Buckley 2013)
Generika (die den richtigen Inhaltsstoff ohne Markennamen verkaufen) sind aber für viele Menschen in ärmeren Ländern die einzige Möglichkeit, um an qualifiziert-gute Medizin heranzukommen.
Weil also Wirtschaftsinteressen gefährdet sein könnten, ist die Definition „gefälschter Medikamente“ nach internationalem Recht offenbar nicht einfach (siehe SSFFC, WHO 2017). Bisher hatte die WHO vor allem Sorge die Herstellungsrechte von Firmen zu sichern, und fürchtet, sich durch schärfere Kontrollen zu sehr in den freien Handel einzumischen. (Burci 2013)
Sie setzt stattdessen auf Programme, die die Qualität der Medikamente verbessern sollten.
Bildungs-Initiativen, die Patienten aufklären könnten, wie sie sich so verhalten können, dass sie nur möglichst wenige Medikamente konsumieren müssen, sind dagegen weitgehend unbekannt.
Pharma-Shopping und Medikamente online
Online Apotheken sollen in Deutschland bereits einen Marktanteil von über fünf Prozent halten. Sie können staatliche Vorgaben und Kontrollen bei der Beschaffung ihrer Produkte leichter umgehen. Darüber hinaus ist es möglich sich die Chemie direkt aus dem „dunklen Netz“ (Dark-Net) zu besorgen.
Die Online-Beschaffung von Pharma-Produkten ist gefährlich, weil sie ein höheres Risiko gefälschter oder minderwertiger Medikamente mit sich bringt. Und das das meiste, was online-gekauft wird und dann geschluckt wird ist oft völlig unnötig oder falsch dosiert.
Video
- Interview mit Daniel Harrich („Pharma-Crime“) 02.12.2018: www.youtube.com/watch?v=PzlACu8isos&feature=youtu.be
- CBS: Fight against counterfeight drugs 2011: www.youtube.com/watch?v=6Djftj0bwus
Literatur
- Euroaktiv 24.01.2017
- Nayyar P et al: The Global Pandemic of Falsified Medicines: Laboratory and Field Innovations and Policy Perspectives, Am J Trop Med Hyg. 2015; 92(Suppl 6): 2–7.
- Newton P et.al: Falsified medicines in Africa: all talk, no action. The Lancet, Sept. 2014, Vol 2: e509-510
- Newton P: Unregulated fake medicines are threatening the fight against diseases like malaria New Statesman 29.08.2014.
- Zeit 22.09.14

